Teori Dasar
Percobaan yang dilakukan oleh Johann Balmer (1885) melalui pengamatan spektrum pancaran atom gas hidrogen (H) menunjukkan bahwa energi atom adalah diskrit. Spektrum yang dipancarkan oleh atom gas hidrogen terurai menjadi beberapa spektrum garis berwarna cahaya tampak, seperti merah, hijau-biru, dan ungu. Intensitas dan kedudukan garis spektrum yang teramati menunjukkan karakteristik atom tersebut. Kedudukan spektrum garis tersebut menyatakan suatu orde tertentu dan berkaitan dengan panjang gelombangnya yang dinyatakan dengan hubungan.
Dari Teori Atom Bohr, diketahui bahwa peristiwa pancaran atom gas hidrogen merupakan hasil peristiwa eksitasi dan deeksitasi (transisi atau perpindahan) elektron dari satu kulit atom ke kulit atom lainnya seperti yang ditunjukkan pada gambar di bawah ini.
Spektrum garis yang teramati muncul dari peristiwa difraksi dan interferensi setelah pancaran energi atom tersebut melewati suatu celah sempit (kisi).
Susunan peralatan pada percobaan Deret Balmer.
Langkah Percobaan
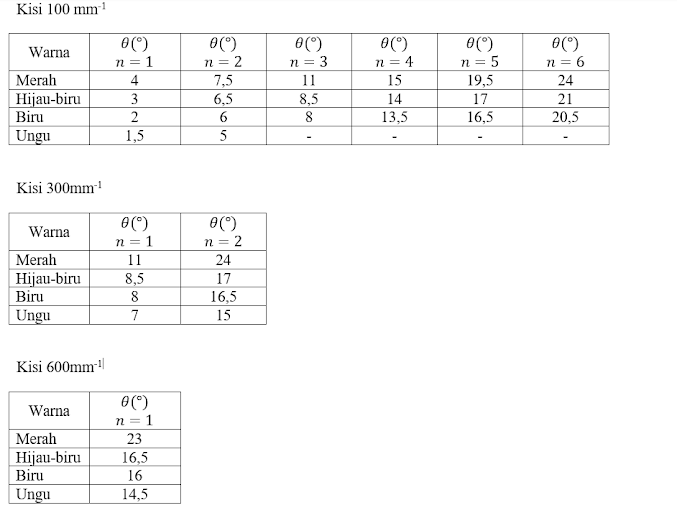
Hasil Pengamatan
Analisa Data
Prinsip kerja dalam percobaan ini yaitu cahaya yang dihasilkan oleh lampu hidrogen mengalami pembelokkan gelombang cahaya yang melewati kisi. Semakin kecil kisi, maka penyebaran gelombangnya akan semakin besar. Hasil difraksi tersebut kemudian mengalami interferensi gelombang atau perpaduan gelombang sehingga spektrum warna merah, hijau-biru, biru, dan ungu dapat teramati pada teleskop.
Garis spektrum yang teramati adalah merah (n=3), hijau-biru (n=4), biru (n=5), dan ungu (n=6) saja. Pada orde n=1 dan n=2 juga terlihat spektrum garis, namun ini tidak berlaku dalam Deret Balmer. Hal ini karena untuk n=1 dan n=2 tidak terdapat garis dengan intensitas tinggi sehingga spektrum yang dihasilkan adalah kontinyu lemah. Oleh karena itu, hasil untuk n=1 menjadi minus dan n=2 menjadi tak hingga. Untuk n > 7, spektrum garis masih terbentuk suatu deretan warna cahaya dengan panjang gelombang yang berbeda-beda.
Pada saat kalibrasi awal di titik 0°, yang muncul pertama kali adalah warna merah (n=3). Warna merah muncul pertama kali karena spektrum warna yang memiliki panjang gelombang terbesar justru memiliki nilai energi E yang paling kecil dibandingkan spektrum warna lainnya. Inti atom yang bermuatan positif, memiliki daya tarik terhadap elektron yang bermuatan negatif. Akibatnya, elektron-elektron di setiap lintasan selalu mengelilingi inti. Elektron yang tingkat energinya terendah (warna merah), paling mudah ditarik oleh inti. Oleh karena itu, warna merah yang tampak terlebih dahulu.








































No comments:
Post a Comment